(尿路上皮癌に対する承認内容)
バベンチオ®の効能又は効果:根治切除不能な尿路上皮癌における化学療法後の維持療法
臨床成績
JAVELIN Bladder 100試験:国際共同第Ⅲ相臨床試験(B9991001試験)1)2)
全患者集団(FAS)における全生存期間(OS)[主要評価項目](中間解析時点)
全患者集団で、バベンチオ®+BSC群はBSC群に対して統計学的に有意なOS改善が認められ、優越性が検証されました〔片側p=0.0005[層別log-rank検定(片側有意水準p<0.0053)]、層別ハザード比0.69(95%信頼区間:0.556,
0.863)〕。
OSの中央値はバベンチオ®+BSC群で21.4ヵ月(95%信頼区間:18.9ヵ月, 26.1ヵ月)、BSC群で14.3ヵ月(95%信頼区間:12.9ヵ月,
17.9ヵ月)でした。OSの追跡期間の中央値は、バベンチオ®+BSC群で19.6ヵ月、BSC群で19.2ヵ月でした。
![OS[全患者集団]Kaplan-Meier曲線](/uc/images/responses/img_01.jpg)
PD-L1陽性患者集団(FAS)における全生存期間(OS)[主要評価項目](中間解析時点)
PD-L1陽性患者集団で、バベンチオ®+BSC群はBSC群に対して統計学的に有意なOS改善が認められ、優越性が検証されました〔片側p=0.0003[層別log-rank検定(片側有意水準p<0.0014)]、層別ハザード比0.56(95%信頼区間:0.404, 0.787)〕。OSの中央値はバベンチオ®+BSC群で未達(95%信頼区間:20.3ヵ月, 推定不能)、BSC群で17.1ヵ月(95%信頼区間:13.5ヵ月, 23.7ヵ月)でした。OSの追跡期間の中央値はバベンチオ®+BSC群で18.3ヵ月、BSC群で20.0ヵ月でした。
![OS[PD-L1陽性患者集団]Kaplan-Meier曲線](/uc/images/responses/img_02.jpg)
全患者集団(FAS)におけるOSのサブグループ解析*1[主要評価項目のサブグループ解析]
全患者集団の事前に規定した因子別OSについて、BSC群に対するバベンチオ®+BSC群のハザード比はそれぞれ、以下のとおりでした。
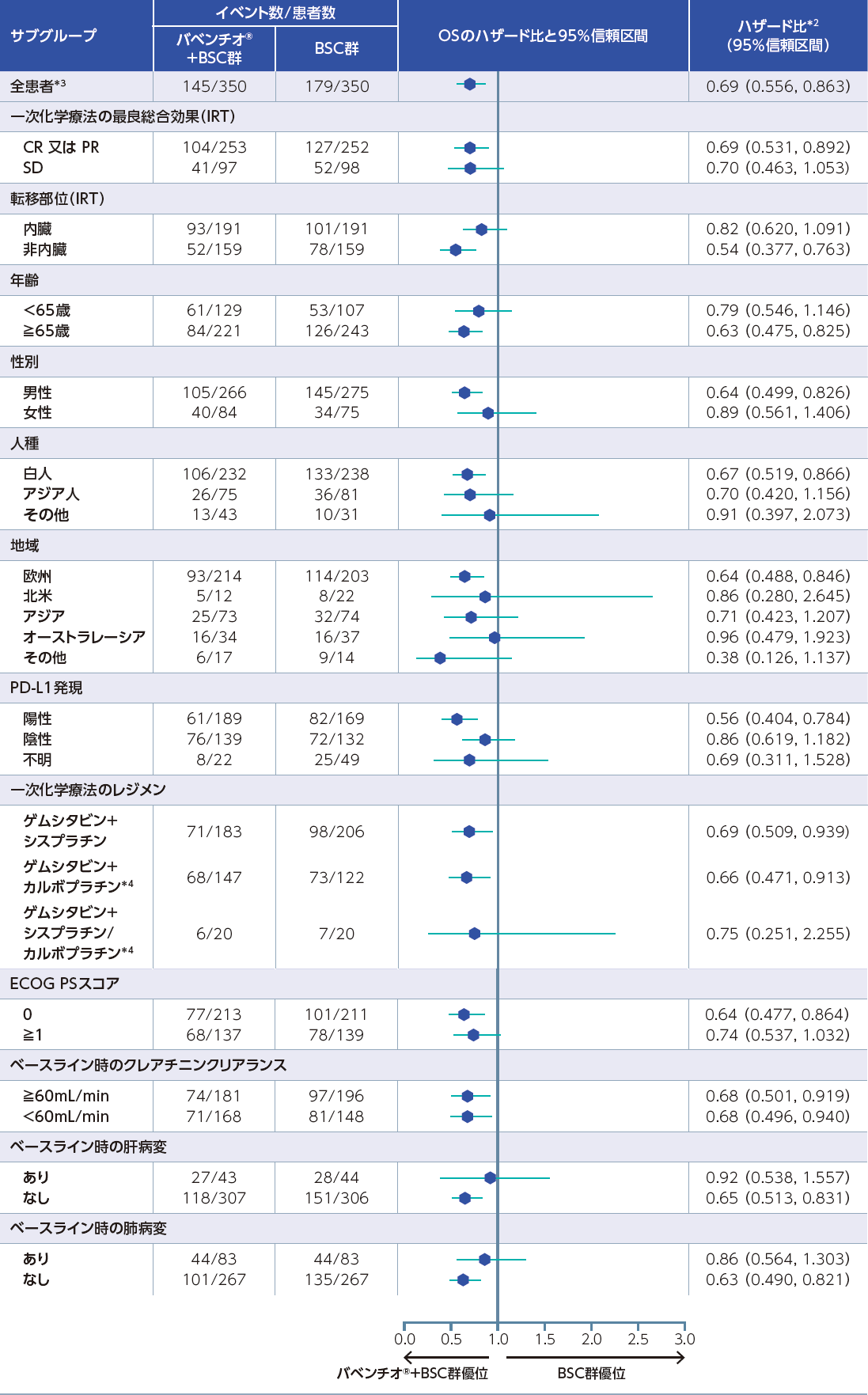
*1:部分集団解析であり、有意性を示す解析ではない
*2:ハザード比及び関連する信頼区間の算出にはCox比例ハザードモデルを使用、全患者以外は層別因子を考慮していない
*3:一次化学療法への最良総合効果(CR又はPR vs SD)及び転移部位(内臓vs非内臓)で層別化。層別化にはinteractive response technology(IRT)システムで収集した層別因子を使用
*4:尿路上皮癌に対する効能又は効果については本邦未承認
全患者集団(FAS)およびPD-L1陽性患者集団(FAS)における次治療としての抗癌剤治療
データカットオフ日時点で、全患者集団において、治験薬投与終了後に少なくとも1種類の抗がん治療を受けていた患者の割合は、バベンチオ®+BSC群で47.7%、BSC群で65.1%でした。
全患者集団において、抗癌剤による次治療を受けた患者の割合は、バベンチオ®+BSC群で42.3%(PD-L1陽性患者集団では36.0%)、BSC群で61.7%(PD-L1陽性患者集団では64.5%)でした。このうち抗癌剤による次治療としてPD-1/PD-L1阻害薬の投与を受けた患者の割合はバベンチオ®+BSC群で6.3%(PD-L1陽性患者集団では5.3%)、BSC群で43.7%(PD-L1陽性患者集団では47.9%)でした。
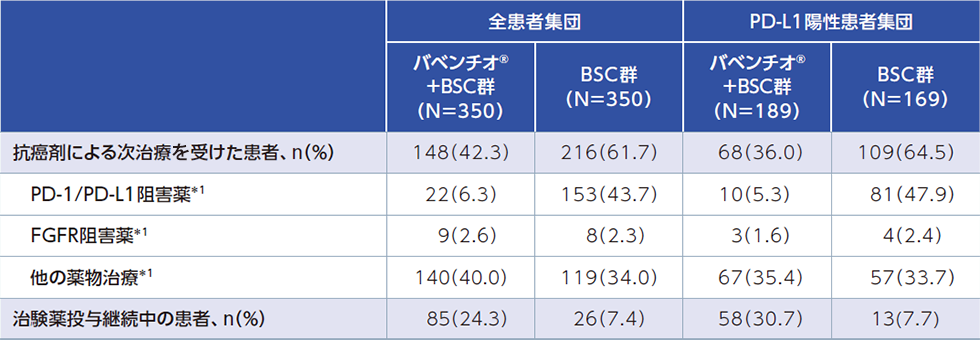
*1:国内未承認薬剤、国内で効能又は効果未承認が含まれます。
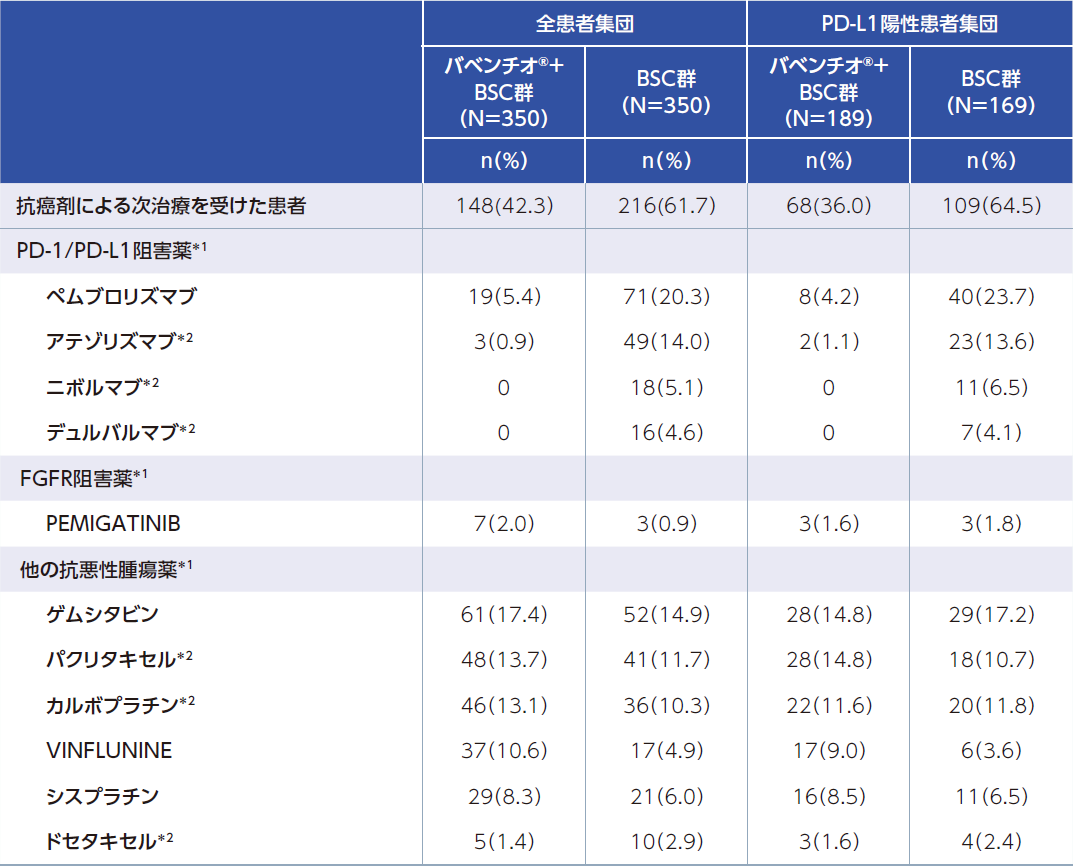
※いずれかの投与群で2%以上の薬剤を表記しています。国内未承認薬剤(英文表記)が含まれます。各製品の電子添文を参照ください。
*1:国内未承認薬剤、国内で効能又は効果未承認が含まれます。
*2:尿路上皮癌に対する効能又は効果については本邦未承認
全患者集団(FAS)における無増悪生存期間(PFS)*1[副次評価項目]
全患者集団において、PFSの中央値はバベンチオ®+BSC群で3.7ヵ月(95%信頼区間:3.5ヵ月, 5.5ヵ月)、BSC群で2.0ヵ月(95%信頼区間:1.9ヵ月, 2.7ヵ月)でした[片側p<0.0001*2(層別log-rank検定)、層別ハザード比0.62(95%信頼区間:0.519, 0.751)]。
![PFS[全患者集団]Kaplan-Meier曲線](/uc/images/responses/img_05.jpg)
*1:RECIST v1.1に基づく盲検下での独立中央判定
*2:多重性調整を実施しておらず、有意性を示す解析ではない
PD-L1陽性患者集団(FAS)における無増悪生存期間(PFS)*1[副次評価項目]
PD-L1陽性患者集団において、PFSの中央値はバベンチオ®+BSC群で5.7ヵ月(95%信頼区間:3.7ヵ月, 7.4ヵ月)、BSC群で2.1ヵ月(95%信頼区間:1.9ヵ月, 3.5ヵ月)でした[片側p<0.0001*2(層別log-rank検定)、層別ハザード比0.56(95%信頼区間:0.431, 0.728)]。
![PFS[PD-L1陽性患者集団]Kaplan-Meier曲線](/uc/images/responses/img_06.jpg)
*1:RECIST v1.1に基づく盲検下での独立中央判定
*2:多重性調整を実施しておらず、有意性を示す解析ではない
全患者集団(FAS)におけるPFSのサブグループ解析*1[副次評価項目のサブグループ解析]
全患者集団の事前に規定した因子別PFSについて、BSC群に対するバベンチオ®+BSC群のハザード比はそれぞれ、以下のとおりでした。
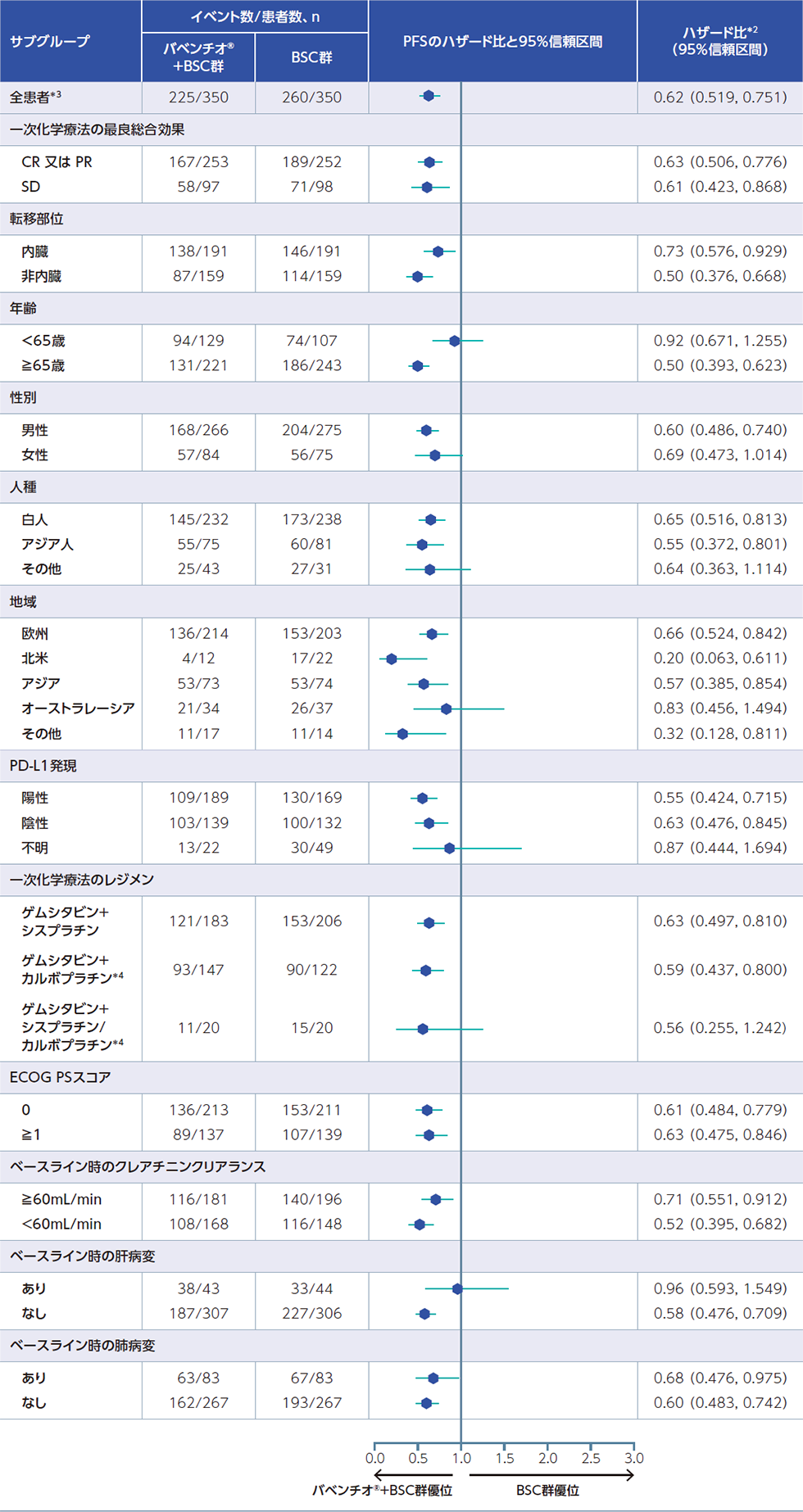
*1:部分集団解析であり、有意性を示す解析ではない
*2:ハザード比及び関連する信頼区間の算出にはCox比例ハザードモデルを使用、全患者以外は層別因子を考慮していない
*3:一次化学療法への最良総合効果(CR又はPR vs SD)及び転移部位(内臓vs非内臓)で層別化。層別化にはinteractive response technology(IRT)システムで収集した層別因子を使用
*4:尿路上皮癌に対する効能又は効果については本邦未承認
客観的奏効(OR)*1・病勢コントロール(DC)*1(FAS)[副次評価項⽬]
全患者集団において、ORRはバベンチオ®+BSC群で9.7%(95%信頼区間:6.8%, 13.3%)、BSC群で1.4%(95%信頼区間:0.5%,
3.3%)でした[層別オッズ比7.464(95%信頼区間:2.824,
24.445)]。
PD-L1陽性患者集団において、ORRはバベンチオ®+BSC群で13.8%、BSC群で1.2%でした[層別オッズ比12.699(95%信頼区間:3.160,
114.115)]。
![客観的奏効率(ORR)*1[副次評価項目]](/uc/images/responses/img_08.jpg)
*1:RECIST v1.1に基づく盲検下での独立中央判定
*2:95%信頼区間はClopper-Pearson法で算出
*3:オッズ比はMantel-Haenszel法で推定
*4:(CR+PR+SD+Non-CR/Non-PD)の症例数
奏効までの期間(TTR)、奏効期間(DR)[副次評価項目]
![奏効までの期間(TTR)、奏効期間(DR)[副次評価項目]](/uc/images/responses/img_09.jpg)
患者報告アウトカム(PRO)(FAS)[副次評価項目](参考情報)
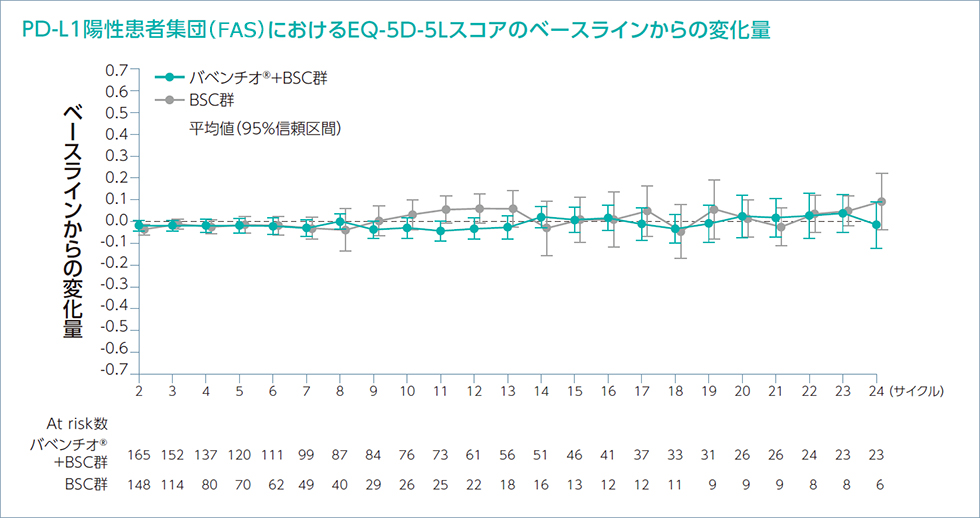
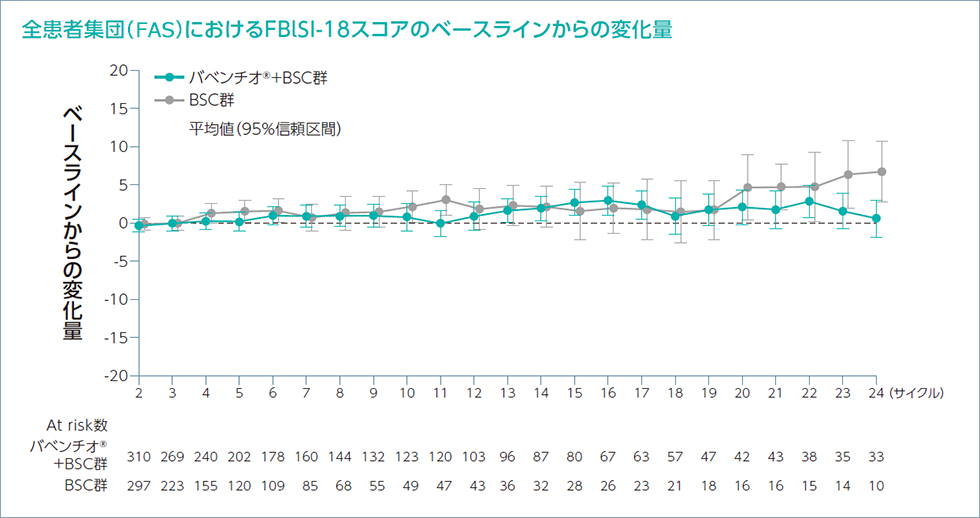
EQ-5D-5L及びNCCN-FACT - FBlSI-18質問票を用いて健康関連QOLのPROを評価しました。
患者報告アウトカム(EQ-5D-5L及びNCCN-FACT -
FBlSI-18)への治療による影響を推定するためにベースラインからの差を制御するランダム係数モデルを用いて解析を行いました。EQ-5D-5L及びFBlSI-18に基づくバベンチオ®+BSC群の健康状態及びQOLは、以下の通りでした。
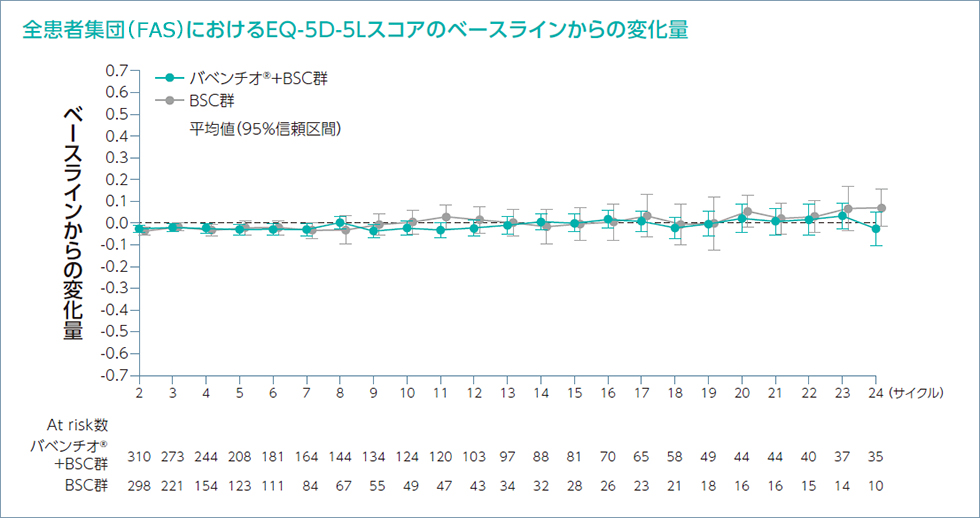
各サイクルの1日目に来院して質問票に回答してもらい評価した。
第1サイクル1日目の投与後の評価はベースライン評価ではないため、解析から除外された。
EQ-5D-5L(EuroQol 5 dimension 5 levels):健康関連QOLを測定するために開発された包括的な評価尺度。指数スコアが高いほど健康状態が良好であることを示す。
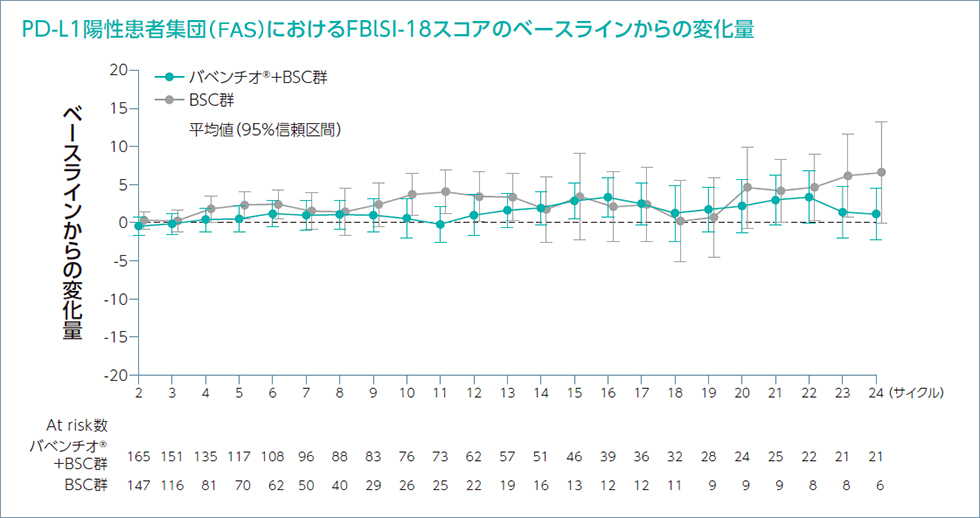
各サイクルの1日目に来院して質問票に回答してもらい評価した。
第1サイクル1日目の投与後の評価はベースライン評価ではないため、解析から除外された。
NCCN-FACT - FBlSI-18(National Comprehensive Cancer Network - Functional Assessment of Cancer Therapy –
Bladder Symptom Index-18 items):18の質問を用いた膀胱癌患者のQOLの測定法。指数スコアが高いほど健康状態が良好であることを示す。
安全性(安全性解析対象集団)
-
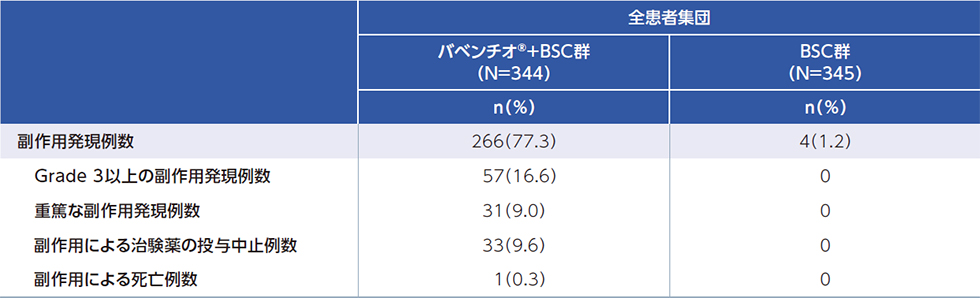
副作用は、バベンチオ®+BSC群で344例中266例(77.3%)、BSC群で345例中4例(1.2%)に認められました。
主な副作用は、バベンチオ®+BSC群で、そう痒症47例(13.7%)、甲状腺機能低下症36例(10.5%)、下痢35例(10.2%)でした。BSC群で、背部痛、頭痛、尿路感染、カンジダ感染各1例(0.3%)でした。 - 重篤な副作用は、バベンチオ® +BSC群で31例(9.0%)に認められ、主な重篤な副作用はバベンチオ®+BSC群で注入に伴う反応4例、大腸炎2例、血中クレアチニンホスホキナーゼ増加2例等でした。BSC群では認められませんでした。
- 治験薬の投与中止に至った副作用は、バベンチオ® +BSC群で33例(9.6%)で、その内訳は、注入に伴う反応4例、リパーゼ増加3例、トロポニンT増加3例、アラニンアミノトランスフェラーゼ増加、アミラーゼ増加、大腸炎、間質性肺炎が各2例等でした。BSC群では認められませんでした。
- なお、データカットオフ時点で、全患者集団における死亡は、バベンチオ®+BSC群で144例(41.9%)、BSC群で176例(51.0%)に認められました。試験期間全体及び治験治療終了から30日以内のいずれの期間においても、主な死亡理由は、両治療群ともにPDでした。治験薬に関連する毒性により、バベンチオ®+BSC群の2例が死亡し、内訳は敗血症、虚血性脳卒中各1例でした。虚血性脳卒中による死亡はバベンチオ®を1回のみ投与した患者で投与100日後に認められました※。BSC群では認められませんでした。
※ 治験実施計画書の有害事象に該当しないため、副作用による死亡は敗血症の1例のみとなりました。
1)社内資料:国際共同第Ⅲ相試験(B9991001試験)(2021年2月承認)承認時評価資料
2)Powles, T. et al. : N Engl J Med 383(13): 1218, 2020
本試験は、Merck及びPfizerの提携の一部として、Pfizerのスポンサーシップのもと実施されました。
2023年7月 JP-AVE-00411




